|
|
| |
| |
 |
核心蛋白聚糖对鼠肌腱细胞 I 型胶原及其 mRNA 的影响 |
熊 雁, 张正治, 孙 玮
( 第三军医大学高原军事医学系中心实验室, 重庆 400038)
肌腱愈合中围绕骨纤维鞘的纤维性粘连形成, 导致肌腱愈后功能下降是手外科的一大难题。而这种粘连形成的主要原因是, 肌腱损伤后转 化生长因子( transforming growth factor TGF-β 等的过度表达[1], 外 )源性的滑膜鞘等成纤维细胞快速增生[2], 导致广泛的紊乱无序的胶原沉积在肌腱和腱鞘之间, 从而限制了肌腱的滑动导致肌腱功能难以恢复。
核心蛋白聚糖( decorin, DCN) 作为肌腱中含量最高的蛋白多糖, 是纤维性组织和胞外基质( extracellularmatrix, ECM) 的一种重要成分。DCN 不仅能负性调节TGF-β[3], 而且能够抑制胶原纤维的形成, 使肌腱按照应力的方向重建。我们通过检测 DCN 对大鼠肌腱细胞 I型胶原的影响, 探明其在肌腱胶原形成中的机制, 为将来的在体实验和临床应用提供依据。
1 材料与方法
1.1 材料
肌腱取自 0.175~0.180kg 的成年 SD 大鼠的跟腱, 雌雄不限( 第三军医大学实验动物中心提供) ; Decorin 购于 sigma 公司; 胰蛋白酶, I 型胶原酶系 sigma 公司分装, DMEM/F-12 培养液, 胎牛血清购于 Hyclone 公司。Ⅰ、Ⅲ型胶原一抗、二抗 SABC(链酶亲合素- 生物素- 抗生物素复合物) 、DAB 显色试剂盒和 FITC 标记的荧光二抗均购自武汉博士德公司。总 RNA 提取试剂盒、通用RT- PCR 试剂盒、DNAmark 均购于博大泰克公司, 上游引物、下游引物由北京三博远志公司设计合成。Leica TCSNT 型激光共聚焦显微镜。
1.2 大鼠肌腱的原代培养:
无菌条件下取 SD 大鼠后肢跟腱 2 ̄4 cm, 用 Hank’s 液洗净表面血液, 手术显微镜下剥离腱外膜组织后, 用 Hank’s 液洗涤 3次。将整段肌腱用含 0.25%胰蛋白酶及 0.1%胶原酶的混合液在37℃水溶液中消化 30 min, 血清终止消化后再用眼科剪将肌腱剪成 1 ̄3 mm3 碎块。一部分采用组织块法培养: 放入 50 mL 培养瓶中, 向瓶内加入少量 10%的含胎牛血清的 DMEM/P12 培养液(约1 mL), 置入 37℃、5% CO2 培养箱中培养, 24 h 后组织块与瓶壁粘着后取出再加入完全培养液。另一部分采用消化法培养: 继续用含 0.25%胰蛋白酶及 0.1%胶原酶的混合液在 37℃水溶液中消化 1.5 h, 血清终止消化后, 过滤去除组织块, 滤液于 1000 r/min,离心 10 min, 去掉上清, 加入培养基, 吹打制悬, 细胞计数, 按 5×105 个 /mL 接种于 25 mL 的培养瓶, 置入 37℃、5% CO2 培养箱中培养。待原代培养的细胞生长融合成片, 用 0.25%胰蛋白酶消化,传代培养, 实验用第 3 ̄4 代细胞。
1.3 大鼠肌腱细胞的鉴定
取第 3 代细胞接种于多聚赖氨酸处理的盖玻片上爬片培养,24 h 后细胞长满盖玻片, 采用免疫细胞化学 SABC 法, 对细胞进行 I、Ⅲ型胶原染色, 鉴定兔肌腱细胞。
1.4 免疫细胞化学定性检测 I 型胶原的改变
取第 3 代细胞接种于多聚赖氨酸处理的盖玻片上爬片培养,12 h 细胞贴壁后, 实验组加入 DCN, 使其浓度为 50 μg/μL, 对照组加入等量的培养液, 继续培养 12 h 后, 方法同上进行免疫细胞化学染色, 定性观察 I 型胶原的改变。
1.5 免疫荧光法定量检测 I 型胶原的改变
同上实验组和对照组进行细胞爬片培养, 长满玻片的 70%
的时候取出, 0.01 mol/L 的 PBS 洗 5 min×3 次。4% 多聚甲醛固定30 min, 0.01 mol/L 的 PBS 洗 5 min×3 次 。3%过 氧 化 氢 孵 育10 ̄20 min, 消除内源性过氧化物酶的活性。蒸馏水冲洗, PBS 浸泡 5 min。1% 的 Triton 溶液处理 10 min, 0.01 mol/L 的 PBS 洗 5min×3 次。滴加试剂 5%BSA 封闭液, 室温孵育 20 min, 倾去, 勿洗。滴加 1:100 比例稀释的一抗, 37℃孵育 1 h, 后 4℃过夜。PBS冲洗, 3 min×3 次。滴加试剂 1:60 的 FITC 标记的羊抗兔的荧光二抗, 37℃孵育 60 min, PBS 冲洗, 3 min×3 次。滴加 1μg/mL 的PI 染核, 室温避光( 锡箔包裹) 反应 15 min, PBS 冲洗 3 min×3次。50%甘油封片, 激光共聚焦显微镜下检测。采用 0.12 μm 距离逐层扫描细胞, 每个细胞得到 60 张图片, 后进行延伸焦距合成得到图片。
1.6 RT-PCR 检测 I 型胶原 mRNA 的改变
取对数期生长的细胞接种于 50 mL 培养瓶, 贴壁生长 12 h后, 实验组加入 DCN, 使其浓度为 50 μg/μL, 对照组加入等量的培养液。细胞生长 12 h 后, 胰酶消化, 离心制悬, 计数细胞。后按照每 2×106 细胞加入 1 mL 的 Trizol, 按照 RNA 提取试剂盒提取总 RNA。提取的总 RNA 测定 A260/A280 值在 1.8 ̄2.0 之间, 同时计数出 RNA 的浓度。取 5 μL 行 1%变性琼脂糖凝胶电泳, 28、18 及 5 S 条带清晰可见, 说明 RNA 无降解。 将 mRNA 逆转录为 cDNA, 使用 20 μL 体系( 主要包括以下成分: 10 mmol/L dNTPs、200U/μL MMLV、5×MMLV 反 应 缓 冲液、Oligo( dT) 16、50U/μL Rnasin、1.5 μg 总 RNA) 于 37℃水浴反应 2 h, 95℃热变性 5 min 终止反应。 后在 50 μL 体系进行 PCR 反应, 引物序列如下: collagentype I:正义链 5'-CCTACCCAGCACCTTCAAATCC-3'μTm62.6,反义链 5'-CCTCCCTTGTTAAATAGCAC- CGTC-3' Tm 63.5, 产物片段 533 bp; 内参 μ-actin: 正义链 5' - CTGCCGCATCCTC-TTCCTC- 3' Tm 60, 反义链5'- CTCCTGCTTGCTGATCCACAT- 3'Tm 60, 产物片段 398 bp。 反应体系 ( 主要成分如 下 : 2μL 反 转 录 产 物 、10 mmol/LdNTPs、5U/μL Taq 酶、10×PCR 反应缓冲液、25 pmol/μL 引物, 25mmol/L MgCl2、ddH2O) 94℃预变性 5 min, 反应 32 个循环,每循环94℃变性 50 s、57.5℃退火 5 s、72℃延伸 1 min, 最后 1 个循环72℃再延伸 8 min。 反 应 产 物 于 2%琼 脂 糖 凝 胶 电 泳 ( 含 0.5 mg/L, ethidiumbromide, EB) , 凝胶成像分析仪对电泳各条带进行光密度定量分析, 将 I 型胶原的灰度值与内参照 β-actin 的灰度值进行比较, 得出实验组和对照组 I 型胶原 mRNA 的相对含量。
1.7 统计分析
所有数据均应用 SPSS10.0 统计学软件处理。结果以均值±标准差表示(x±s), 组间以 t 检验进行处理, P<0.05 为相差显著。
2 结果
2.1 大鼠肌腱细胞的培养鉴定
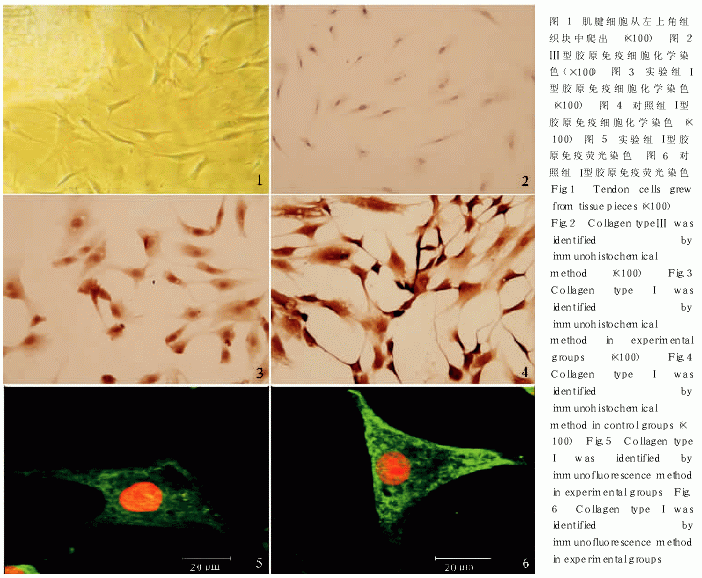
组织块置入培养瓶后, 倒置显微镜下观察, 平均第( 6.2±0.08) d 见组织块周边有腱细胞呈放射状爬出, 与组织块边缘垂直, 并向远处贴壁生长( 见图 1) 。消化法培养的细胞, 24 h 开始贴壁, 后逐渐延展为梭形和多角形。7 d 左右达到对数生长期, 形态上属于成纤维细胞类型。
免疫细胞化学染色鉴定, Ⅲ型胶原染色阴性, I 型胶原染色阳性( 见图 2, 4) , 证明所培养的细胞为大鼠肌腱细胞。
2.2 DCN 对 I 型胶原影响的定性观察
免疫细胞化学对 I 型胶原染色, 实验组明显比对照组的颜色减弱, 定性观察说明实验组 I 型胶原合成减少( 见图 3, 4) 。
2.3 DCN 对 I 型胶原影响的定量分析:
实验组和对照组各取 5 张细胞爬片, 免疫荧光染色后在激光共聚焦纤维镜下对 75 个肌腱细胞的 I 型胶原进行定量分析。实验组平均荧光强度( 122.35±22.05)明显弱于对照组平均荧光强度( 130.36±27.09) , P<0.05,相差显著( 见图 5, 6) 。
2.4 DCN 对 I 型胶原 mRNA 的影响:
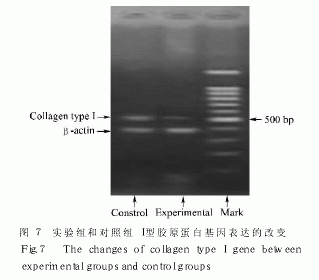
采用半定量反转录聚合酶链反应( RT-PCR) 方法检测 I 型胶原 mRNA 的表达。与正常对照组相比, 实验组 I 型胶原蛋白的表达明显下调, mRNA 水平明显低于对照组, P<0.01, 相差非常显著( 电泳结果见图 7, 结果见表 1) 。
采用半定量反转录聚合酶链反应( RT-PCR) 方法检测 I 型胶原 mRNA 的表达。与正常对照组相比, 实验组 I 型胶原蛋白的表达明显下调, mRNA 水平明显低于对照组, P<0.01, 相差非常显著( 电泳结果见图 7, 结果见表 1) 。
3 讨论
DCN 是富含亮氨酸的小分子的蛋白聚糖家族( small leucine-rich proteoglycans , SLRPs) 中的一员。成纤维细胞, 软骨细胞, 内皮细胞和平滑肌细胞都能够合成 DCN, 其主要分布在骨, 软骨, 肌腱, 巩膜, 皮肤, 大动脉和角膜等结缔组织, 属于细胞外基质, 又叫做 PG-2,PG-II, PG-S2, PG-40 和 DS/CS-PGII。由于电镜下显示其在胶原网络中能够修饰胶原纤维, 故又称为饰胶蛋白聚糖。DCN 能够通过其位于核心蛋白中心区域上游离的半胱氨酸的结合位点和胶原Ⅰ、Ⅱ、Ⅲ、Ⅴ、Ⅵ、Ⅶ、Ⅻ作用, 抑制胶原的纤维化, 从而使的 DCN 在抗纤维化,防止瘢痕形成, 促进愈合方面的研究成为热点。Rees[4]等对牛肌腱中可聚蛋白聚糖, DCN 和双链蛋白聚糖的分解代谢检测发现: 小分子蛋白聚糖 DCN 有一个快速更替, 提示对胶原基质完整性的作用可能有着另外的分子途径。
另一方面 DCN 能与 I 型胶原的三股螺旋每个 D区 d 带部位结合, 两者相互作用后促进原纤维侧面结合以形成纤维和纤维束。DCN 结合在胶原原纤维表面,阻止三股螺旋的胶原分子之间的错误融合, 调节胶原纤维的成熟。DCN 核心蛋白部分在交错的原纤维之间的显微裂隙处结合胶原原纤维, 而带电荷的糖胺聚糖链链伸出来调节原纤维的距离, 确定组织中胶原原纤维的精确的布局。因此 DCN 可能是通过结合到胶原上从而推动一个有序的融合过程, 产生优势条件下最佳的胶原纤维。Redaelli 等[5]发现结合在 DCN 上的糖胺聚糖链在每 64-68nm 胶原原纤维中象桥梁一样连接附近的原纤维, 这种结构提示: DCN 上的糖胺聚糖链可能在原纤维中起到力量传导作用, 使得肌腱的结构完整。由于 DCN 能调整胶原原纤维的纤维化, Nakamura 等[6]在兔韧带损伤模型中运用 DCN 反义基因治疗方法提高了早期瘢痕中胶原原纤维形成, 以及抗拉力增加和瘢痕爬行距离延长, 显示出其在提高皮肤, 肌腱等软组织愈合中存在潜在的应用价值。 近年来, 随着对肌腱愈合中 TGF-β、胰岛素样生长因子 (insulinlike growth factor-I, IGF-I)、血管内皮生长因子 (vascular endothelial growth factor, VEGF)、血小板源生长因子 (platelet-derived growth factor, PDGF) 、碱性成纤维细胞生长因子 (basic fibroblast growth factor,bFGF)、表皮生长因子 (epithelial growth factor, EGF)等细胞因子的研究深入, 人们发现不同的细胞因子在不同时间和不同肌腱愈合位点起着不同的作用, 调节肌腱的愈合的时间, 方向以及愈合质量, 而其中的 TGF-β认为在肌腱愈合中发挥着关键性的作用。Flanagan[7]等通过对羊胚胎肌腱损伤模型研究发现胚胎肌腱损伤后是无瘢痕愈合, 而胚胎环境中 TGF-β1 及其 mRNA 含量明显低于成年组织, 这提示胚胎的无瘢痕愈合机制可能就是这种低浓度的 TGF-β1 环境造成的。
另一方面, Klein 等[8]人发现在兔腱鞘,腱外膜、腱内膜细胞培养中, TGFβ1、 、 都可以使肌腱中最主要 β2 β3的 I 型胶原明显增加。Zhang 等[9]人发现在腱鞘成纤维细胞、腱外膜细胞、腱内膜细胞的培养中加入 TGF-β中和抗体能以剂量依赖方式明显减少 TGF-β诱导的 I 型胶原的产生, 这提示 TGF-β抗体可以阻断肌腱愈合中TGF-β的作用, 减少组织纤维化, 减少瘢痕形成。Chang等[10]人直接用 TGF-β1 抗体发现能提高兔屈肌腱损伤愈合后的活动范围, 从而在体内动物实验上证明了抑制 TGF-β可以达到改善肌腱愈合的作用。DCN 作为一种体内天然的 TGF-β负性调节因子, 通过与 TGF-β的受体竞争性结合, 起到 TGF-β的单克隆抗体一样的抗纤维化作用, 从而提示 DCN 在肌腱愈合中能够起到减少瘢痕形成, 促进愈合, 减少粘连, 提高术后肌腱功能恢复的效果。
在本实验中, 我们观察到: 50 μg/μL 的 DCN 作用大鼠肌腱细胞 12 h 后, 能够明显减少肌腱细胞的 I 型胶原蛋白的合成, 免疫荧光定量分析实验组和对照组相差显著。而且在早期 DCN 还能够显著降低肌腱细胞I 型胶原蛋白 mRNA 水平的表达。这些结果提示, 在肌腱愈合的早期恰当的运用 DCN 可以达到调整胶原的成熟, 减少无序紊乱的胶原在肌腱和腱鞘之间沉积, 从而改善肌腱术后愈合质量, 提高肌腱术后的功能。 DCN 在肌肉, 关节腔, 肾脏, 皮肤, 肺, 肝, 眼等组织器官中的抗纤维化作用, 让人们对脏器纤维化以及瘢痕粘连的防治看到了新的方向。在体外实验中, DCN 直接注射, DCN 基因导入, 反义基因的导入等不同治疗方法均取得了良好的效果。Kazumasa[11]等通过直接注射DCN 到损伤的肌肉中, 使得肌肉的结构和功能得到近乎完全的康复, 从而获得了美国骨科协会颁发的 2000年 Cabaud 奖。但是 DCN 的使用的剂量、时间、方式、以及临床效果等需要进一步的实验研究。
|
|
|
|
|
|
| |
| |
|

