|
|
| |
| |
 |
成骨生长肽对大鼠成骨细胞 I 型胶原蛋白的影响 |
丁 波, 黄 姣, 何 斌
( 重庆医科大学附属口腔医院内科, 重庆 400015)
研究发现, 骨组织由 1/3 的有机物和 2/3 的无机物构成, 其中 I 型胶原蛋白占到有机物中的 80%~90%, 它对骨组织结构的完整以及维持其生物力学特性起着非常重要的作用[1]。I 型胶原蛋白构成了骨组织的蛋白框架, 它的合成分泌是骨组织形成的前提条件, 加速其合成分泌将起到促进矿化的作用[2]。因而, I 型胶原蛋白可以作为成骨细胞分化的一个检测指标。成骨生长肽( Osteogenic growth peptide,OGP) 是一种促进成骨作用的多肽类生长因子[3]。已证实, 该生长因子在加快骨折愈合, 预防和治疗骨质疏松等方面有良好的效果[4]。
目前, OGP 对成骨细胞的胶原蛋白是否具有调节作用尚不清楚。本实验通过细胞免疫化学的方法观察 OGP 对成骨细胞胶原蛋白的影响, 旨在探讨OGP 对成骨细胞作用的机制, 为进一步研究提供实验依据。
1 材料与方法
1.1 主要试剂和仪器
F12 培养基( GIBCO 公司, 美国) ; 新生小牛血清( 哈里生物, 成都) ; OGP( SIGMA 公司, 美国) ; 6 孔板培养板( Corning公司, 美国) ; 兔抗鼠 I 型胶原蛋白抗体( BOSTER) ; 生物素化山羊抗兔抗体 ( BOSTER) ; DAB( 北京中杉金桥生物技术公司) ; YJ- 2450 医用净化工作台 ( 苏州净化设备厂) ; Leica 显微镜( 德国) ; 图像分析系统 Image- Pro Plus 4.5( Media Cy-bernetics L.P., 美国) 。
1.2 细胞来源和培养
在无菌条件下取新生 24h 内的雄性 SD 鼠 ( 四川大学华西医学实验动物中心提供) 颅盖骨, 用镊子去除表面膜层,Hank’s 液清洗 3 次, 剪碎, 将组织碎块均匀地铺散在 75ml培养瓶底壁上。翻转培养瓶, 将有组织块的瓶底向上, 加入5ml 含 20%小牛血清的 F12 培养基, 置于 37℃、5%CO2 培养箱中培养。4h 之后翻转培养瓶, 置培养箱中继续培养。待细胞生长融合长满瓶底时, 进行消化传代。
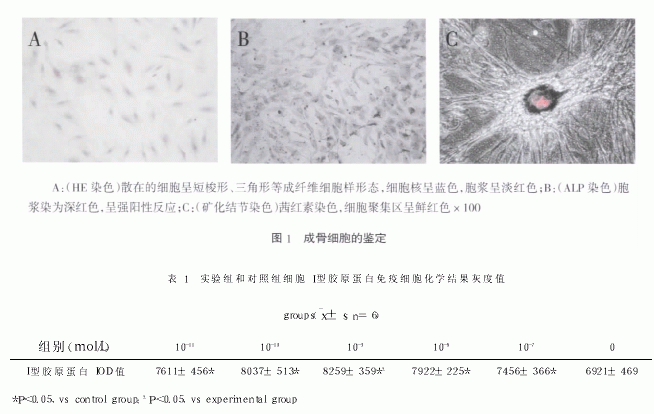
1.3 成骨细胞的鉴定
取第三代细胞爬片, 用 PBS 液清洗, 95% 乙醇固定, 行
碱性磷酸酶( ALP) 染色, HE 染色。取培养至第七代的细胞行
茜红素矿化结节染色。
1.4 OGP 对成骨细胞的刺激
将第四代传代细胞制备细胞爬片。待细胞贴壁生长良好
时更换无血清培养基继续培养 24h, 分别加入终浓度为
10-11、10-10、10-9、10-8、10-7mol/L 的 OGP, 在加入后 7 天取出细
胞爬片, 进行细胞免疫化学染色。对照组不加 OGP。
1.5 细胞骨架的荧光染色
采用 SABC 法进行免疫细胞化学染色。第一抗体为 I 型胶原蛋白兔抗鼠多克隆抗体, 第二抗体为链酶亲和素化山羊抗兔 IgG。设置阴性对照( 用 PBS 液代替一抗, 其余条件不变) , 以排除内源性污染所至的非特异性反应, 避免出现假阳性。取出细胞爬片, 按下述步骤分别进行胶原蛋白染色: 预处理玻片; 滴加 5%BSA 封闭液, 室温下孵育 10min; 抗体反应,分别加入一抗和二抗; DAB 溶液显色; 封片。
1.6 图像分析
采用图像分析系统对染色切片进行检测。在 200 倍显微镜下将每张切片按系统抽样法随机选择 4 个视野进行下列指标测定: 1.棕黄色阳性颗粒的总面积; 2.棕黄色阳性颗粒的平均透光度( Mean density) 。然后, 通过计算平均 IOD 值得出阳性染色强度。
平均 IOD 值= 平均透光度×平均阳性面积
1.7 统计学方法
实验所得数据以均数±标准差表示, 采用 SPSS10.0 统计分析软件进行处理。采用单因素方差分析处理组间各值的比较, P<0.05 为有统计学意义。
2 结 果
2.1 成骨细胞的鉴定
经鉴定, 本实验所获取的细胞为成骨细胞( 图1) 。
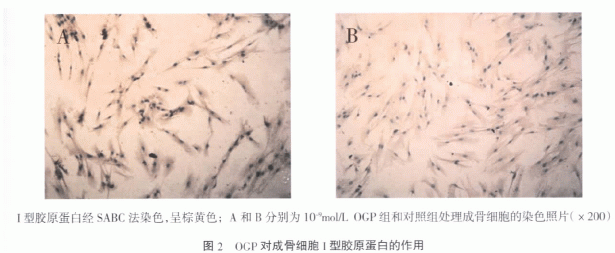
2.2 成骨细胞 I 型胶原蛋白免疫细胞化学染色结果 实验组和对照组的成骨细胞在培养 7 天后, 细胞内 I 型胶原蛋白染色均表达阳性, 表现为细胞浆呈棕黄色或棕褐色, 细胞核周围最为明显; 各组间因培养基内所含 OGP 浓度的不同, 其 I 型胶原蛋白表达量也有所不同, 因而染色结果有所差异( 图 2) 。不同浓度的 OGP 作用下, 成骨细胞 I 型胶原蛋白染色的灰度值见表 1。由表可见, 实验组中 I 型胶原蛋白免疫组化染色的灰度值均较高, 范围在 ( 7456±225) ~8259±359) 之间, 而对照组仅为 6921±469。根 (据统计学分析, 各实验组 I 型胶原蛋白染色的灰度值与对照组相比, 差异具有统计学意义( P<0.05) ; 在各实验组之间, OGP 浓度为 10-9mol/L 的实验组成骨细胞 I 型胶原蛋白染色的灰度值最高, 与其它实验组相比, 差异也具有统计学意义( P<0.05) 。
3 讨 论
随着口腔种植学理论的不断完善和技术的不断发展, 特别是骨整合理论的提出和完善, 使得骨内种植体在临床上广泛应用, 并取得了巨大的成功。但是, 这项技术也存在着一些亟待解决的问题。例如, 如何尽早实现种植体表面与骨之间形成骨整合, 从而缩短种植修复的治疗时间。选择合适的生长因子促进成骨细胞的分化, 为解决此类问题提供了很好的方法。目前, 国内外学者对多种生长因子,如骨形成蛋白( BMP) 、转化生长因子( TGF) 、成纤维细胞生长因子( FGF) 等, 做了大量研究, 也取得了一定进展。但这些生长因子在免疫原性、临床使用成本等诸多方面存在着各自的不足。1992 年, Bab 等首先报道了愈合的骨髓组织能产生促进成骨细胞增殖的活性因子, 通过进一步分离、纯化, 得到一个14 个氨基酸组成的多肽, 命名为成骨生长肽[3,4]。随后的研究发现其具有促进成骨和造血的作用, 同时发现其氨基酸序列在进化上的保守性, 暗示了其潜在的生物学价值和医学价值。因此, 研究 OGP 在口腔种植学领域中的应用具有极好的前景。
研究证实, I 型胶原蛋白是形成骨机械力量的主要因素, 其合成的有序排列的胶原纤维越多, 新形成骨的强度就越高[5,6]。因此, 研究 OGP 对细胞胶原蛋白合成的影响, 对明确其对细胞成骨的能力有着重要的意义。在本实验中, 从成骨细胞 I 型胶原蛋白的免疫细胞化学染色结果可以发现, 加有 OGP 的实验组中的成骨细胞 I 型胶原蛋白的表达含量均显著地高于相应的对照组( P<0.05) , 说明 OGP 在成骨细胞的体外培养时能促进其成骨分化的进程, 并且当培养基中 OGP 浓度为 10-9mol/L 时, 这种作用最为明显。研究结果可以解释 Sun 等在兔胫骨骨折模型研究中发现的使用 OGP 的实验组骨折愈合时间明显缩短, 并且新形成的骨具有更好的力学性能[7,8]。其原因之一就是因为 OGP 通过促进成骨细胞 I 型胶原蛋白的合成, 加速钙盐的沉积, 进而缩短了骨折愈合的时间。
因此, 本实验结果提示应用 OGP 能诱导成骨细胞 I 型胶原蛋白表达的增加, 既可以促进骨的形成,也可以提高新生骨的机械力学性能, 具有很好的应用前景。但仍需通过进一步的体内实验来验证。
|
|
|
|
|
|
| |
| |
|

