张云松, 高建华, 鲁 峰, 朱 茗, 廖云君
(南方医科大学南方医院整形外科, 广东 广州 510515)
人脂肪干细胞具有增殖能力和多向分化潜能,对多种组织的损伤具有良好的修复作用, 而且取材方便, 是组织工程研究中的重要种子细胞之一[1,2]。理想的种植材料应具有良好的生物相容性, 对细胞、组织等无毒性。不同材料对细胞的生长、分化和黏附均有不同的影响, 因而种子细胞能否在支架材料上良好生长, 并表达自身特异性功能是目前组织工程研究的一个热点。本实验首次用人脂肪干细胞与 I 型胶原支架材料进行体外混合培养, 了解支架材料对细胞粘附、生长、增殖等功能的影响, 以便寻找适宜的脂肪组织工程细胞载体, 为进一步的体内实验提供理论依据。
1 材料与方法
1.1 试剂
DMEM、特级胎牛血清由 Gibco 公司生产; I 型胶原酶、胰蛋白酶、I 型胶原支架材料、四氮唑复合物(XTT), 硫酸酚嗪甲酯和二甲基亚砜均购自 Sigma, 1
孔细胞培养板购自 Corning。
1.2 方法
1.2.1 脂肪组织来源的脂肪干细胞(ADSCS) 原代、传代培养[2] 取人吸脂术中吸出的脂质部分, 用缓冲液反复冲洗, 剪刀剪碎。0.1%胶原酶 37 ℃消化 40 min,期间需反复震荡混匀 1 次, 使用等量体积的完全培养基中和后, 离心 1300×g 5 min, 去上清, 沉淀混悬后使用肽盼蓝染色检测细胞活性, 加入 10% DMEM 培养基中, 37 ℃5% CO2 孵箱培养过夜。待细胞生长融合达 80%即可传代, 取第 3 ̄4 代细胞供实验用。
1.2.2 细胞 - 支架复合物的形成 将胶原蛋白支架材料裁制成 10 mm ×10 mm ×1 mm 大小, 利用紫外线照射及酒精浸泡消毒, 培养液平衡后待用。培养的脂肪干细胞消化后制成细胞悬液, 细胞密度为 2×105/ml,表面种植 0.2 ml 细胞悬液, 静置 4 h 后,加入含 20%胎牛血清的 DMEM 培养液, 37 ℃、 5% CO2 培养箱中培养。
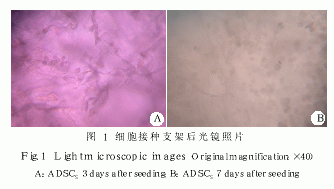
1.2.3 倒置显微镜观察 细胞接种支架后, 动态观察细胞在支架上粘附、伸展、生长、分裂情况。
1.2.4 细胞黏附率检测 根据 Kasten 报道的方法 做 [3]了部分改进。取 24 孔培养板,在孔内植入备用的胶原蛋白支架材料 7 块, 大小约 10 mm ×10 mm ×1 mm将细胞浓度为 2×105/ml 的细胞悬液 0.2 ml 滴加到料上,静置 4 h 后,置于孵育箱中复合培养 4 h, 换于另一平皿, 加入培养液, 将原平皿中细胞消化收集, 计数仪计数, 得出流失的细胞数; 细胞材料复合物培养 24h 后, 在培养液中轻轻晃动, 换于另一平皿, 重复上述步骤, 得出未黏附细胞数。粘附率 =(接种细胞数 - 流失细胞数 - 未粘附细胞数)/ (接种细胞数 - 流失细胞数)×100%。
1.2.5 XTT 比色法[4]测定细胞增殖状况 将胶原支架材料 7 块(5 mm×5 mm×1 mm)分别置于 96 孔培养板中, 并设 7 孔为不加材料的空白对照组, 各 4 个复孔。
将 ADSCS 以 1×104/ 孔接种于材料及空白孔, 置 37 ℃5% CO2 孵箱培养 3、5、7 d, 以主波长 450 nm, 参比波长 630 nm 在酶标仪上比色, 测定吸光度 A 值。
1.2.6 扫描电镜观察 细胞 - 支架复合物体外培养至3 d 和 7 d 时, 取出材料, 3%戊二醛固定, 梯度酒精脱水, 临界点干燥, 横截面表面喷金, 扫描电镜观察。
1.2.7 统计学处理 所得数据采用 SPSS11.0 软件包进行统计分析, P<0.05 为差异有显著意义。
2 结果
2.1 细胞 - 支架复合物倒置显微镜观察
刚接种的细胞呈圆形, 在支架材料内均匀分布;透光性差, 24 h 内细胞伸展、黏附,透光性增加, 不易观测。 2 ̄3 d 已完全伸展变形, 以三角形和梭形为主, 呈网状排列;随着培养时间的延长,支架上的细胞逐渐由梭形变成圆形, 种植 7 d 后, 细胞数量明显增加,极少细胞从支架上掉落。表明脂肪干细胞能在支架上良好地附着、生长和增殖(图 1)。
2.2 细胞黏附率检测
经检测, 7 块复合材料中, 每块细胞黏附率均达95%以上, 平均达 97.9%, 说明该支架对细胞有良好的黏附性。
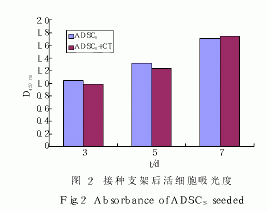
2.3 XTT 法检测材料上细胞增殖情况
从活细胞吸光度所绘制的细胞增殖柱形图来看( 图 2), 细胞接种后, 实验组和空白组随时间延长细胞活性逐渐增加, 仍可保持正常的分裂增殖速度, 两
组之间组相比未见显著性差异(P>0 .05)。
2.4 扫描电镜观察
细胞种植 3 d 后, 细胞呈扁平多角形或圆形, 在材料表面伸展、黏附; 种植 1 周后, 形态为梭形或圆形, 细胞数量明显增多, 呈聚集性分布, 细胞周围有大量基质, 表明脂肪干细胞在支架上粘附、伸展和生长良好(图 3)。

3 讨论
胶原蛋白是目前组织工程学研究中最常用的天然生物材料, 由多种糖蛋白分子组成, 占机体总蛋白的 30% (85%为 I 型胶原蛋白), 它具有多方面的生物活性, 不仅是组织支持物, 而且是细胞外间质的重要成分。研究表明, 胶原蛋白生物相容性好, 降解速度可调, 而且可参与组织修复, 是一类优良的可引导组织再生的生物材料。Ⅰ型胶原作为体外细胞培养支架时, 有促进细胞粘附和诱导生长分化的作用, 是良好的培养粘附剂。其降解产物可被细胞利用合成新的基质。不产生毒性代谢产物, 不影响内环境 pH 值, 因此不会影响细胞的生长增殖。胶原蛋白及相关制品已广泛应用于临床医学中[5,6], 已被美国 FDA 批准作为人工皮肤材料[7]。
本研究利用人脂肪干细胞作为种子细胞, 进行体外细胞种植胶原支架, 通过倒置显微镜和电镜观察细胞伸展、黏附和生长过程。镜下显示, 种子细胞种植胶原材料后, 生长状态良好, 无明显细胞毒性表现, 在培养条件相对稳定的情况下, 细胞可以进行正常增殖、迁移并分泌细胞外基质。通过检测, 细胞与支架的黏附率达 97%以上, 说明该支架对细胞有良好的亲和性。
XTT 法常用于体外细胞增殖和药敏检测, 通过测定活细胞光吸收值, 间接反映活细胞数量。本实验中, 细胞支架培养复合培养后, 材料接种组细胞的增殖未受到不良影响, 说明 I 型胶原支架对人脂肪干细胞无毒性作用。
本实验表明, 人脂肪干细胞能在 I 型胶原支架材料上良好的附着、生长、增殖并在三维支架材料内保持均匀分布。I 型胶原支架材料与人脂肪干细胞具有良好的体外生物相容性, 可作为构建脂肪组织工程的细胞载体。
|

