史向阳1 孙曹民2 吴世康1
(1中国科学院感光化学研究所,北京100101,2北京理工大学生物材料实验室,北京100081)
脂质体作为一种内层含有水相的封闭的圆球形双层膜,用于药物释放系统,具有两个独特的优点:1)可以在其内水相包封水溶性药物,也可以在外层双层膜包封脂溶性药物;2)它和天然生物膜的生物相容性比较好,在药物学应用中,安全性可靠.然而,脂质体不论其组成、尺寸大小和表面所带电荷如何,它都能够在静脉给药1小时后被网状内皮系统(RES)截留[1].因此,对脂质体进行表面修饰的主要目的是:1)延长脂质体的半寿期和提高它在血液循环中的稳定性;2)改变脂质体的生物学分布;3)产生靶向效应;4)使脂质体具有独特的性能,如使它具有对pH、温度和光等外界刺激产生敏感性.
研究证实,利用神经节甘酯[2]或者聚乙二醇(PEG)衍生物[3~6]对脂质体进行表面修饰可以提高其稳定性.另外,Sunamoto等人[7~9]也利用多糖衍生物包覆脂质体,能够有效地延长脂质体的体内循环时间.除此之外,一系列的生物相容性合成高分子,无论是中性的或是荷电的,都已被用于提高脂质体的稳定性而得到较多的研究[10,11].近期的研究工作证实,高分子作为脂质体的包覆材料不仅只是扮演一个被动的保护角色,而且可能在实际上通过接受外来的刺激而参与控制药物的释放过程[12].Tirrell等人报道了利用对pH敏感的聚电解质包覆磷脂双层膜,可以得到对pH敏感的脂质体[13,14].此外,有关对光敏感的脂质体也已有人报道[15~17].对温度敏感的脂质体,最初是从改善双亲类脂分子的相变温度开始的[18].近年来,由于发现疏水化修饰的聚N 异丙基丙烯酰胺(PNIPAM)在水溶液中同样具有低临界溶液温度(lowercriticalso lutiontemperature,LCST)行为[19,20],Ringsdorf和Winnik等人[21,22]开展了将PNI PAM进行疏水化修饰用于提高脂质体稳定性的研究.所用的烷基修饰物能够作为锚基使高分子吸附在类脂双层膜上,从而使脂质体得到稳定.由于疏水化修饰的PNIPAM类双亲高分子在温度升高到其LCST以上时,同样存在一个coil globule转变,引起其侧链烷基的收缩,故而可能导致脂质体膜的重新组织,引起其内包容物的快速释放.本文基于此,设计合成了NIPAM和ODA(摩尔投料比为100:1)的共聚物,研究了NIPAM·ODA共聚物包覆的脂质体中水溶性标记物5(6) CF的温控释放行为.
1 实验部分
1.1 实验材料与试剂
大豆卵磷脂(PC),生物试剂,北京市海淀区微生物培养基制品厂,按文献[23]用氧化铝柱层析进一步纯化.5(6) CF,由北京大学化学与分子工程学院李福绵教授赠送.3 甲氧基 4’ N,N 二甲氨基黄酮(DMMF)的合成见注 .NIPAM按文献[24]合成,使用前在环己烷/正己烷(体积比1∶1)中重结晶纯化.ODA由东方化工厂研究中心提供.其它试剂均为分析纯.
1.2 共聚物的合成与表征
将NIPAM(10mmol),ODA(0.1mmol),AIBN3×10 2mmol溶于15mL新蒸的四氢呋喃中,氮气保护下搅拌.保持反应温度为60~65℃,反应5h.冷却,将反应混合物倒入400mL乙醚中,有白色沉淀物出现.将此沉淀物重新溶于40mL四氢呋喃中,重复以上过程3次,得到较纯的白色粉末状聚合物.反应式见下页.共聚物组成比是利用DPX 400型核磁共振波谱仪,通过测定不同单体具有的特征位置的质子峰面积比而确定.图1所示为共聚物以CDCl3为溶剂的1HNMR谱图.其中化学位移δ=0.8处的峰应归属于丙烯酸十八酯链端-CH3上的氢,而化学位移δ=4.0处的峰则为N 异丙基丙烯酰胺上的异丙基叔碳上的氢质子.通过计算这两种氢的峰面积比值,就可得到NIPAM ODA共聚物的组成比.计算结果为106∶1,它比NIPAM和ODA单体的投料比大约6%.
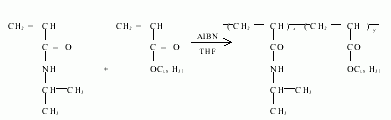
共聚物分子量测定是采用Waters150C型凝胶渗透色谱仪,以窄分布的聚苯乙烯试样为标准,四氢呋喃为流动相.结果为:
Mn=3156 Mw=5617 Mw/Mn=1.781.3
共聚物LCST的测定NIPAM ODA共聚物的LCST的确定采用荧光探针法.本研究选用的探针分子DMMF的结构为:

这种探针分子具有下列特征:若以DimrothET(30)值作为溶剂的极性参数,与DMMF在不同溶剂中荧光光谱的峰值波长λmax作图,可以得到一条良好的线性关系曲线.因此可用它为探针来检测其周围环境的极性,并进而推断大分子在溶液中的构象变化.将DMMF溶于甲醇中,浓度为2.5×10 3mol/L.配制浓度为0.5mg/mL的共聚物水溶液,将DMMF的甲醇溶液加入到共聚物水溶液中,使其最终浓度为2.5×10 6mol/L.荧光光谱在HitachiMPF 4型荧光光谱仪上测得.激发波长为380nm,发射光谱在400~610nm范围内记录.激发和发射狭缝均为12nm.
1.4 包覆共聚物的脂质体的制备
取卵磷脂的氯仿溶液,倒入50mL圆底烧瓶中置于旋转蒸发器上,用水泵减压和加热(30℃)干燥,在烧瓶内壁形成均匀薄膜.于室温下继续减压蒸发2h,除去残余溶剂.加入50mmol/L的5(6) CF溶液(由磷酸盐缓冲液pH7.4配制),在氮气保护下,利用CQ250型水浴超声发生器(上海超声波仪器厂,220V,50Hz)超声30min,所得混悬液即为脂质体.将共聚物溶解在pH7.4磷酸盐缓冲液中,配制成浓度为2mg/mL的共聚物水溶液,按照共聚物和PC的重量比为1:1将其加入到脂质体中,混合均匀,室温下平衡2h完成包覆后,通过SephadexG 50凝胶柱纯化,除去未包封的5(6) CF和未参与包覆的共聚物.
1.5 水溶性标记物从脂质体中的释放
本研究采用5(6) CF为水溶性标记物,5(6) CF具有这样的特点:在稀溶液中荧光强度正比于浓度,但当它的浓度超过10mmol/L时,其荧光发生自猝灭.这种特性可用于脂质体膜通透性的测定.一般情况下,脂质体通透性的测定采用5(6) CF泄漏的百分率R表示:
R=100[I-I]/[I-I](1)
其中If为泄漏出5(6) CF的荧光强度,I0为实验开始时的背景荧光强度,I∞为加入Tri tonX 100(最终浓度为3g/kg左右)使膜结构完全破坏后测得的总荧光强度.利用Hi tachiMPF 4型荧光光谱仪测量脂质体中泄漏出5(6) CF的荧光强度,激发波长为490nm,在520nm处记录5(6) CF的发射强度,激发和发射狭缝均为6nm.
1.6 脂质体膜流动性的测定
配制DMMF浓度为2.5×10 3mol/L的甲醇溶液,将其加入到按照上述方法制备的未包覆5(6) CF的脂质体混悬液中,超声混匀,使其最终浓度为2.5×10 6mol/L.然后按共聚物和PC的重量比为1:1加入共聚物溶液(由pH7.4的磷酸缓冲液配制),混匀.测量探针分子在脂质体包覆前后,在不同温度下其偏振度的变化,借以表征脂质体双层膜流动性的变化.荧光偏振的测量是在HitachiMPF 4型荧光光谱仪的激发和发射光路中插入偏振滤光片进行,将发射偏振器平行于和垂直于激发偏振器时所求得的强度I‖和I⊥组合起来,按下式求得稳态偏振值P[25]:
P=(I‖-I⊥)/(I‖+I⊥)(2)
发射波长固定于475nm,样品在395nm处激发.
2 结果与讨论
2.1 共聚物LCST的确定
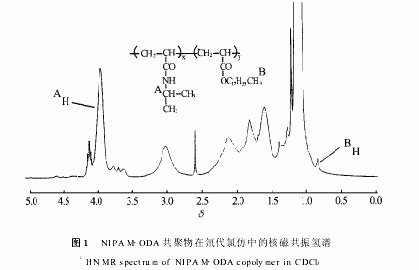
图2给出了探针分子DMMF在0.5mg/mL的共聚物水溶液中,其在485nm处的相对荧光强度(relativeintensityoffluorescence)RIf随共聚物水溶液温度变化的关系曲线。可以看出,当温度范围在20~28℃之间时,DMMF的RIf基本保持不变.当温度升高到30℃时,DMMF的RIf有一突跃,证明了共聚物水溶液在该温度时发生了相分离,这个温度就是共聚物的LCST.
对于共聚物在水溶液中的相分离现象,可认为是:在温度低于LCST时,由于共聚物中酰胺基团和其周围水分子间形成氢键[26],使高分子表现为一种伸展的线团结构.当温度升高至LCST以上时,氢键破坏,使与共聚物结合的水分子释放出来,导致高分子间疏水相互作用加强,致使高分子由疏松的线团结构变为紧密的胶粒状结构,发生了coil globule转变.由于选用的DMMF探针分子对其周围微环境的极性变化非常敏感,且乐于处于亲油的结构之中.在LCST之下,探针分子处于高分子伸展的线团结构中,由于内含结合的水分子,极性较大,荧光强度甚低,且基本上没有变化;而在LCST以上时,高分子形成了紧密的疏水结构,水分子被挤出,致使其周围微环境的极性急剧降低,因此荧光强度出现突跃.随着温度的继续升高,聚合物体积基本上不再收缩,根据这一情况,探针分子的荧光强度不应继续发生明显改变。然而在本研究中出现了在温度高于共聚物的LCST时,探针分子的荧光仍不断上升的现象。这可能是由于即使当体系温度达到共聚物的LCST时,也并非表明所有的探针分子都处在共聚物的疏水结构中。随温度的升高,其运动速度加快,使更多的探针分子进入亲油性的Globule结构内,因而其荧光强度在高于LCST时仍继续增大.
2.2 共聚物包覆的脂质体中水溶性标记物的温控释放
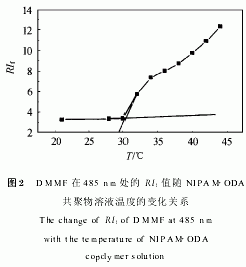
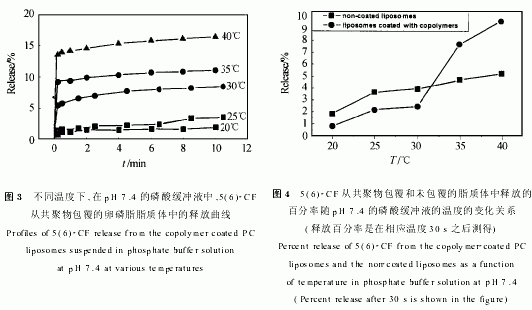
对于共聚物包覆和未包覆的脂质体,在加入最终浓度为3g/kg的TritonX 100对脂质体膜破坏后,5(6) CF的释放量几乎相等,可见,对脂质体进行共聚物包覆并不影响脂质体对水溶性标记物的包封.图3给出了不同温度下5(6) CF从共聚物包覆的脂质体中的释放百分率随时间变化的曲线.可见,5(6) CF在30℃以下的释放百分率受到限制,而在35℃以上时,其释放百分率大大提高.图4给出了从共聚物包覆和未包覆的脂质体中,在不同温度下,30s后5(6) CF的释放百分率曲线.可见,5(6) CF从共聚物包覆的脂质体中的释放百分率在30~35℃之间突然增大.这个温度区间和共聚物的LCST很好地吻合.和图3相比,图4更清楚地显示了共聚物对脂质体的包覆,在30℃以下能够明显延缓5(6) CF的释放;而在35℃以上时则明显地提高了5(6) CF的释放百分率.
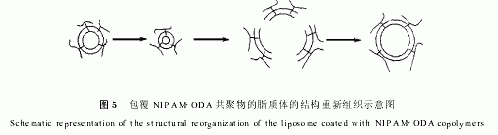
对于共聚物包覆的脂质体的温控释放行为,可讨论如下:在温度低于共聚物的LCST时,共聚物侧链上的十八烷基,通过强烈的疏水相互作用,紧密地锚接在脂质体双层膜上,使脂质体得到稳定.而当温度高于共聚物的LCST时,共聚物由于发生coil globule转变,导致其侧链十八烷基的收缩,巨大的收缩应力使脂质体膜受到破坏,引起5(6) CF的快速释放.
2.3 共聚物包覆的脂质体膜的流动性变化
在低粘滞性或非玻璃态溶液中,在分子的激发态寿命期内,荧光发色团的旋转运动能够改变发射跃迁距的取向,从而导致发射荧光的振子系统偏离原有的方向,使荧光发生去偏振.这种荧光的去偏振作用,可用线偏振的Perrin公式来表达:
1/P 1/3=(1/P0 1/3)(1+KTτ/ηV)(3)
式中P0是当体系中不发生分子旋转及发光分子与相邻分子间无相互作用(如能量转移或迁移)条件下的极限偏振值,K和T则分别为Boltzman常数和绝对温度,τ是荧光寿命,V是分子体积,η是发光分子的环境粘度.因此,如已知P0及τ值,并估计出在溶液中发光分子的体积V,可按测得的P值算出探针分子所处的环境粘度.目前人们借助于能够敏感地进入分析区域的荧光探针,将荧光偏振技术广泛地用来研究天然的或人工的膜脂区的流动性[27].本研究利用一种新型的分子内电荷转移化合物DMMF作为荧光探针,由于该探针的亲油性较强,很容易进入类脂双层膜中,故而可以研究脂质体膜在被共聚物包覆前后的偏振度,借以表征脂质体膜流动性在包覆前后的变化.实验结果如表1所示.由表1可见,对于未用共聚物包覆的脂质体来说,随着温度的升高探针分子的偏振度越来越小,表现为脂质体膜的流动性越来越大.这主要是由于脂质体双层膜的自身的分子运动随温度升高而加快,导致其内探针分子的运动加快,更易去偏振所致.而对共聚物包覆的脂质体而言,在温度低于其LCST时,虽然共聚物侧链上的长链十八烷基紧密地锚接在脂质体双层膜上,但由于共聚物分子量较小,并不能引起脂质体膜流动性的显著变化.而当温度升高到共聚物的LCST时,由于共聚物自身发生coil globule转变,可能引起脂质体膜重新组织,分裂形成小的脂质体系统,导致DMMF偏振度的降低.关于水溶性高分子,在特定的条件下,发生coil globule转变导致脂质体膜重新组织为小的脂质体系统,Tirrell等人已经作过证实[28].所以当温度继续升高时,这些小的脂质体系统运动加快,可能会进一步融合形成大的脂质体,因而此时,DMMF的偏振度又表现为突然增大.脂质体的重组织过程由图5进行描述.当然这一过程的机制比较复杂,特别是大的脂质体的形成,也可能包含有几个脂质体的融合等,进一步的工作尚在进行中.

|

