琚正川,陈 洁,肖智成(同济大学化学系,上海 200092)
温敏性微凝胶在药物控制释放[1]、固定化酶和固定化细胞[2]、蛋白质脱水[3]及人造肌肉[4]等一系列领域的应用越来越受到人们的关注.聚N 异丙基丙烯酰胺(poly N isopropylacrylamide,PNIPAM)是一类典型的温敏性聚合物,在其低临界溶解温度(lowercriticalsolutiontemperature,LCST)以下溶于水,一旦环境温度超过LCST则会迅速收缩,从水中析出.为了扩大PNIPAM的应用范围,人们将一些亲水性或疏水性的单体与其共聚,形成一些新的微凝胶体系,如P(NIPAM AA),P(NIPAM AM),P(NIPAM MAA)等[5,6].
二烯丙基二甲基氯化铵(diallydimethylammoniumchloride,DADMAC)是美国食品与药物管理局(foodanddrugadministration,FDA)批准的能直接用于饮用水处理的第一批聚合物材料.它含有高度亲水的季铵盐基团,在水中能完全电离,具有适度的线性电荷密度———适中的电荷间距使得其他分子更易于与它发生作用,对人体几乎无害,特别适用于生物与医药领域.将DADMAC与NIPAM共聚,不但增强了PNIPAM的稳定性,而且使得其他分子更易于与它发生作用.通过乳液聚合法将DADMAC与NIPAM共聚,可形成一种新的温敏性微凝胶体系———P(NIPAM DADMAC),而利用红外光谱及氢核磁共振波谱可对其进行表征,同时利用动态光散射仪可间接测定其LCST,并对这种微凝胶进行氟哌酸的吸附释放实验.
1 实验部分
1.1 试剂及仪器
(1)试剂:NIPAM(分析纯,fluka),DADMAC(60%水溶液,东京化成工业株式会社生产),TDBAC(十八烷基二甲基苄基氯化铵,化学纯,上海试剂厂生产),V50(双正丙基氯化铵,分析纯,aldrich),MBA(N,N 亚甲基双丙烯酰胺,分析纯,fluka),KOH(分析纯,上海山海工学团实验二厂生产).
(2)仪器:Brookhaven动态光散射仪,VarianGermini2000氢核磁共振仪,Nicolet205傅立叶变换红外光谱仪,HP7530G紫外 可见分光光度计,TGL16G台式高速离心机.
1.2 P(NIPAM DADMAC)的合成
将NIPAM与DADMAC以摩尔比8∶2的比例倒入磨口三颈瓶中,再加入适量的交联剂MBA、乳化剂TDBAC及50ml的去离子水,通入氮气去氧,同时用电磁搅拌器以200r·min-1的恒定速度搅拌30min.将体系置于水浴中恒温(70℃),再加入引发剂V50,在搅拌状态下反应2h;倒出乳液,冷却至室温,对乳液离心分离;倒出上层清液,将沉积在底部的产物重新溶解、离心,直至上层清液吸光度为零.将纯净的产物真空干燥,得到干胶,编号为S1,待用;将NIPAM与DADMAC的摩尔比分别改为9∶1和9.5∶0.5,按同样步骤合成出微凝胶,编号分别为S2和S3.
1.3 P(NIPAM DADMAC)的表征
利用Nicolet205傅立叶变换红外光谱仪测定共聚产物的红外光谱图,如图1所示;利用VarianGer mini2000氢核磁共振仪分别测得NIPAM,DADMAC和共聚产物的核磁共振谱,分别如图2,3,4所示.
1.4 P(NIPAM DADMAC)在不同温度下的粒子直径
将上面得到的微凝胶配成一定质量浓度的溶液,用60μm孔径的聚丙烯微孔过滤器(Millipore)过滤,并在不同温度下稳定30~60min,然后在波长514.5nm、检测角90°、功率15mW氩激光源的条件下,用动态光散射仪测得不同温度下的微凝胶粒子直径(为流体动力学半径的2倍).其结果如图5所示.
1.5 P(NIPAM DADMAC)对氟哌酸的吸附与释放
取一定量的S1干胶配成微凝胶溶液,在2个100ml的锥形瓶中分别加入5ml去离子水及5ml已知质量浓度的氟哌酸溶液,再各加入5ml的微凝胶溶液,摇匀后放入与第2页第15行相同20℃水浴中恒温20min.离心分离30min,取上层清液,以加去离子水的溶液为参比,用HP7530G紫外-可见分光光度计测定其在272.4nm处的吸光度.同样配制2份溶液置于60℃水浴中恒温,按同样步骤测定其吸光度,结果如表1所示.取10mg·L-1氟哌酸溶液及S1,S2,S3,按照同样步骤进行实验,结果如表2所示.

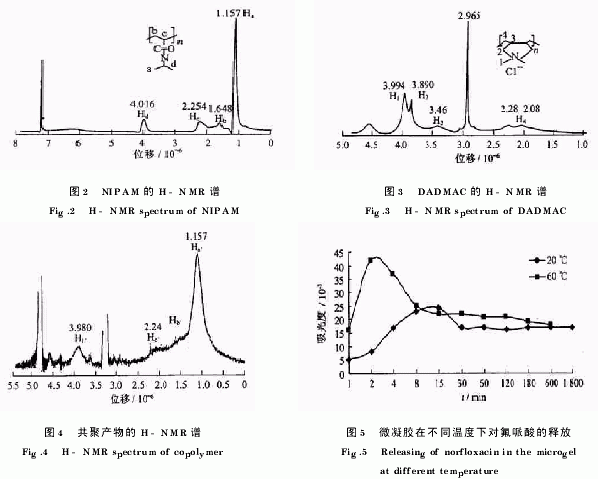
1.6 P(NIPAM DADMAC)在不同温度下对氟哌酸的释放过程取一定量编号为S2的微凝胶加入5ml氟哌酸溶液(50mg·L-1),充分溶解,干燥至恒重;分别在20℃和60℃下加入1000ml水,水浴恒温,每隔一段时间取样3~4ml;测定其在272.4nm处的吸光度,如图5所示.
2 结果与讨论
2.1 谱图解析
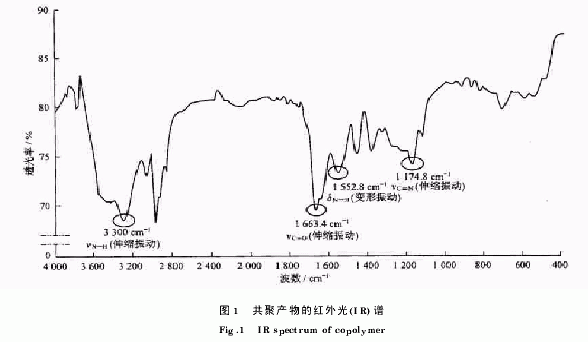
在共聚产物的红外光谱(图1)中,在3300cm-1和1663.4cm-1处出现的强吸收峰分别为仲酰胺的伸缩振动νs,NH与伸缩振动νCO,而在1552.8cm-1和1174.8cm-1处的中等吸收峰则分别是仲胺的变形振动δNH与伸缩振动νCN,730cm-1处的吸收表明体系中有较长的碳链存在.这些都与P(NI PAM DADMAC)的结构符合.在NIPAM均聚物的1H NMR谱(图2)中,Ha峰强度最大且化学位移值最小,所以是异丙基中的甲基质子;Hb峰与Hc峰相邻且强度较小,应为亚甲基质子与相邻的次甲基质子;而化学位移最大的Hd峰则应是异丙基中的次甲基质子.在DADMAC均聚物的1H NMR谱(图3)中,相邻的H1峰与H2峰应分别为甲基质子和与N相连的亚甲基质子,而H3峰与H4峰强度小,应分别为次甲基质子与亚甲基质子.在图4中,NIPAM单元中的3个峰出现在共聚产物的同样位置:Ha′,Hb′,Hc′.但由于噪声及Ha′峰的影响,Hb峰与Hc峰变得难以辨认,而DADMAC单元中的1个峰也出现在共聚产物的同样位置:H′1.因此,可以判定NIPAM和DADMAC形成了共聚物,但由于文献报道两者的竞聚率相差很大,可能导致只有少量的DADMAC参与了反应,因此没有得到在共聚物中两者的比例.
2.2 P(NIPAM DADMAC)微凝胶的临界相变温度(LCST)
对于亲水性的温敏微凝胶,当温度低于LCST时,微凝胶上的亲水基团会与进入其内部的水分子形成氢键,其链段溶于水,微凝胶发生溶胀,使得微凝胶稳定而均匀地分布在水相中.当温度升高至一定程度,氢键受到破坏,链段的疏水性增强,单个微凝胶发生收缩,水分子被排出.同时这种疏水作用又导致微凝胶之间发生相互聚集,形成较大的聚集体[7].
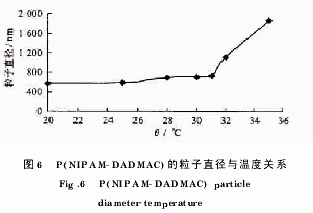
从动态光散射仪测得的结果(图6)可以看出,在31℃之前,粒子直径随着温度的增加而缓慢增大,在约31℃之后粒子直径开始发生突变.这是由于随着温度的升高,微凝胶的空间结构开始坍塌,相邻的粒子会发生聚集,从而使得测得的粒子直径发生突变.因此,31℃即为P(NIPAM DADMAC)微凝胶的LCST.
2.3 P(NIPAM DADMAC)对氟哌酸的吸附与释放
由表1可以看出,对于不同质量浓度的氟哌酸溶液,经过P(NIPAM DADMAC)吸附后,在温度小于LCST、大于LCST时的吸光度均有很大差异.在温度低于LCST时,溶液吸光度小于温度高于LCST时的吸光度,也就是温度低于LCST时,P(NIPAM DADMAC)对氟哌酸的吸附要大于温度高于LCST时的吸附.这是由于当温度低于LCST时,P(NIPAM DADMAC)微凝胶在水中处于溶胀状态,其网络结构的空间能容纳较多的氟哌酸分子;而当温度高于LC ST时,其网络结构发生坍塌,氟哌酸分子就会被排挤出来.这样,就完全可以利用P(NIPAM DADMAC)在不同温度下对氟哌酸的吸附差异性来进行药物控制释放,而且由于其LCST(31℃)接近于人体正常温度(37℃),因而更适合于医药领域.由表2可以知道,随着聚合时DADMAC所占比例的减少,相应P(NIPAM DADMAC)共聚物中DADMAC单元可能也随之减少,因而所吸附的药物量也就随之减少.
2.4 P(NIPAM DADMAC)在不同温度下对氟哌酸的释放过程
图6描述的是在一定量(体积近似不变)的水相中,由微凝胶所释放出的氟哌酸累积量的动力学变化.可以看出,在2种温度下,氟哌酸的释放过程均分为2个阶段.在第一阶段,当吸附了氟哌酸的干态微凝胶加入水中时,在最初的数分钟内,氟哌酸分子大量地进入水相中,被释放出来,氟哌酸的质量浓度逐渐增大至最大值.在低于LCST的20℃的情况下,最初的干态微凝胶在水相中迅速溶胀,由于渗透压的差异,一部分的氟哌酸分子进入水相,导致氟哌酸的质量浓度逐渐增大,约15min后达到最大值;而在高于LCST的60℃的情况下,只需2min即达到最大值,且相应的幅度比20℃时大得多.这正是由于P(NIPAM DADMAC)微凝胶的温敏性所致.在第二阶段,2种温度下水相中的氟哌酸分子皆逐渐趋于恒定,这说明释放出的和重新进入微凝胶内部的氟哌酸分子数量达到了动态平衡.值得注意的是,在高于LCST的温度(60℃)下,尽管微凝胶的网络结构处于坍塌状态,但干态微凝胶仍然吸附一部分水而呈现为湿态微凝胶[8].这就是在60℃的情况下仍然存在上述动态平衡的原因.需要说明的是,本文所研究的氟哌酸分子的释放是在生物活体之外进行的.
3 结论
由上述研究可以得出,通过乳液聚合法能够合成出NIPAM与DADMAC的共聚物微凝胶,其仍然具有温敏性,相变温度大约在31℃.以这种微凝胶作为载体,在对氟哌酸药物控制释放的初步研究中,发现微量阳离子型单元DADMAC的引入对药物的吸附和释放有较大的影响;同样,在LCST之上下,温度的变化也对药物的释放影响很大.目前,对这些影响因素的深入研究正在进行中.
|

