|
|
| |
| |
 |
硫酸粘杆菌素微生物检定法的改进 |
张纯萍1,肖希龙2
(中国兽医药品监察所,北京 100081;中国农业大学,北京 100094)
粘杆菌素是一种抗菌作用较强、毒性较低的多肽类抗生素,目前兽医临床上主要使用其硫酸盐,即硫酸粘杆菌素。研究表明,硫酸粘杆菌素具有良好的促生长和提高饲料利用率的效果,因此被日本、欧美等国家批准用作饲料添加剂。我国农业部于 1986 和1988 年分别批准日本旭化成工业株式会社 和日本明治制果株式会社的添加剂进口。另外,硫 酸粘杆菌素也可内服治疗畜禽的胃肠道疾患。目前 《中华人民共和国药典》(1995版二部和2000版二部) [1,2] 收载了硫酸粘杆菌素的微生物学检定方法,但该 法的检测限较高,很难满足药代动力学研究或进行 残留检测的实际需要,本研究以血清中药物含量为研究对象,对《药典》方法进行了改进,以求最大限度降低其检测限,取得了较为满意的结果。
1 材料与方法
1.1 实验用菌 大肠杆菌标准菌株(Escherichia coliCMCC(B)44103),由中国兽医药品监察所提供。
1.2 试剂 硫酸粘杆菌素标准品,由日本明治制果 株式会社提供(批号Colws-15-20,含量694μg/mg); 培养基(pH7.2~7.4)、灭菌磷酸盐缓冲溶液(pH6.0)
均按《药典》方法配制。
1.3 实验仪器 721分光光度计;牛津杯:不锈钢,高10.0±0.1mm,外径8.0±0.1mm; 游标卡尺:精度 0.02mm; 恒温培养箱。
1.4 标准血清样品的配制 精密称量干燥标准品,用灭菌磷酸盐缓冲溶液(pH6.0)溶解,得到含硫酸粘杆菌素浓度为100μg/ml的溶液,作为标准储备液。 取适量猪的无菌空白血清稀释该储备液,得到含硫酸粘杆菌素浓度分别为0.1、0.2、0.4、0.8、1.6、3.2
和6.4μg/ml的系列溶液,作为标准血清样品。以其 中0.4、1.6、6.4μg/ml的标准溶液作为质量控制(QC) 样品,置-20℃冰箱贮存备用。
1.5 菌悬液的制备 将大肠杆菌在新鲜斜面上连续 传代3次后,用接种环轻轻刮取适量菌苔置于灭菌蒸 馏水中,使菌苔均匀分散其中,然后在600nm 波长 下用灭菌蒸馏水将菌悬液的吸光度(A)调为0.1。菌悬液于实验当天制备。
1.6 实验方法 利用硫酸粘杆菌素在培养基内的扩散渗透作用,将其稀释液加入到已放置在菌层培养基上的牛津杯内,置于冰箱中4℃静置4h,然后于恒温箱中35 ̄37℃培养18h,测量各平板的抑菌圈直径,根据抑菌圈直径的大小进行实验条件的选择及效价 计算。
1.7 实验条件的选择
1.7.1 最适菌层浓度及培养基单/双层的选择 于4瓶100ml融化并冷却至48℃的分析培养基中分别加 入1.0、1.5、2.0、2.5ml菌悬液,制成4种菌层浓度不同的培养基,分别制备单碟和双碟(双碟中底层培养基的加入量为10ml,菌层为4ml;单碟中含菌培养基的加入量为10ml)。在制备好的平板上分别等距离安放3个牛津杯,牛津杯中加入1.6μg/ml的标准血清样品200μl,同1.6项下的方法,测出各平板的抑菌圈直径,以选择最适菌层浓度和单/双碟。
1.7.2 单碟中培养基加入量的选择 以选择好的菌浓制备5个平板,加入培养基的量分别为4ml、6ml、8ml、10ml、12ml。同1.6项下的方法进行单碟中培养基加入量的选择。
1.7.3 牛津杯中加样量的选择 以选择好的菌浓及培养基加入量制备单碟,在制备好的平板上分别等距离
安放3个牛津杯,其中分别加入200μl、250μl、300μl、330μl浓度为1.6μg/ml的标准血清样品,同1.6项下的方法选择牛津杯中的最适加样量。
1.7.4 标准曲线的制备 在每个制备好的平板上等距
离安放6 个牛津杯,将融化后的标准血清系列溶液(300μl)加入其中,同1.6项下的方法测定抑菌圈直径,校正后,以各浓度的自然对数值为纵坐标,以各浓度平均抑菌圈直径的校正值为横坐标绘制标准曲线,并计算此标准曲线的线性回归方程和相关系数。
1.7.5 方法的准确度与回收率的测定 取含硫酸粘
杆菌素浓度分别为0.4μg/ml、1.6μg/ml、6.4μg/ml的QC样品,每个浓度至少用3个平板,同1.6项下的方法测出抑菌圈直径,根据标准曲线计算出QC样品的测得浓度,与配制浓度对照,连续测定5d,每天测定一次,根据测定结果计算方法的准确度和回收率。
2 实验结果
2.1 最适菌层浓度及培养基单/双层按1.7.1项下的方法操作,结果表明,在菌层浓度1.5% ̄2.5%的范围内,随着菌层浓度的增加,抑菌圈直径逐渐减小。不论单层还是双层,在1.0%的浓度时,均不能产生清晰的抑菌圈;菌层浓度为1.5%时,均产生最大的抑菌圈且边缘光滑、完整。此外,在菌层浓度1.5%~2.5%的范围内,单层平板所产生的抑菌圈直径均大于双层平板的抑菌圈直径。因此,本实验选择1.5%为最适菌层浓度,同时选择单层平板进行实验。
2.2 单碟中培养基加入量 按1.7.2项下的方法操作,结果表明,当加入量为4ml时,由于量太少而无法铺平平板,在加入量为6~12ml时,随着加入量的增加,抑菌圈直径逐渐减小,因此选择6ml为单碟中培养基的加入量,这与文献报道的结果一致[3,4]。
2.3 牛津杯中加样量 以1.5%的菌层浓度制备单碟,结果表明,随着牛津杯中加样量的增加,所产生的抑菌圈直径逐渐增大,但当加入330μl时,药液稍有外溢,且培养后仍有部分药液残存在牛津杯内,因此选择300μl为牛津杯中的加样量,此时的加样量刚好与牛津杯的管口相平,不易外溢,且培养后药液渗透完全。
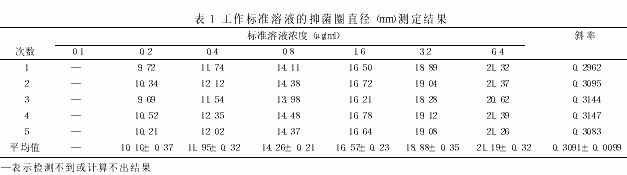
2.4 制备标准曲线 以0.1、0.2、0.4、0.8、1.6、3.2、6.4μg/ml的系列浓度标准血清溶液制备标准曲线,结果见表1。
由表1可知,0.1μg/ml浓度不能产生清晰的抑菌圈,而0.2μg/ml是产生清晰抑菌圈的最低浓度,说明本方法的检测限为0.2μg/ml,这与用博德特氏菌ATCC4617作检测菌的检测限[5,6]基本一致。在不同时间制备5组标准曲线,其斜率的变异系数为3.2%,表明本实验条件下制备的标准曲线变异程度小,具有良好的可重复性。在0.2~6.4μg/ml的浓度范围内,抑菌圈直径与药物浓度的自然对数值呈良好的线性关系,相关系数r=0.9989,标准曲线的线性回归方程为:LnC=0.3085-4.6557x。
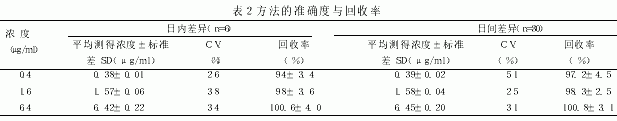
2.5 方法的准确度与回收率 根据1.7.5项下的方法操作,以1d内测得的药物浓度计算日内变异系数,以5d内测得的药物浓度计算日间变异系数,并计算出平均回收率,结果见表2。
由表2 可知,3 个浓度的QC 样品,其日内变异系数为2.6%~3.8%,平均回收率为94%~100.6%;而日间变异系数为3.1%~5.1%,平均回收率为97.2%~100.8%。结果表明,测定血清中硫酸粘杆菌素含量的分析方法重复性好,符合有关规范[7]的要求,可用于药代动力学或残留检测实验。
3 讨 论
目前国外测定硫酸粘杆菌素的药代动力学或进行残留检测所用的菌株大多为支气管炎博德特氏菌ATCC4617[8,9],其在血清或组织中的检测限为0.05~0.3μg/ml。但该菌株对培养基的要求条件较高、比较容易死亡且操作不便,中监所吴佩玲[10]经过实验,认为可以用大肠杆菌 CMCC(B)44103 代替博德氏菌ATCC4617 检测硫酸粘杆菌素的含量;此外,《中国药典》也规定以大肠杆菌CMCC(B)44103 作为检测菌,因此本实验以大肠杆菌为检测菌,并对《药典》的方法作了适当的改进。
由抗生素在琼脂内扩散的动力学公式r2=4DT[LnM-LnC-Ln(4πDTH)]可知,抑菌圈直径与抗生素扩散时间(T)、管中抗生素总量(M)呈正相关,而与培养基的厚度(H)呈负相关。本实验对以上各种因素条件均进行了研究,结果与动力学公式相符,并确定了各种因素值。由于硫酸粘杆菌素的分子量较大,在培养基内扩散缓慢,本研究采用先在冰箱中4℃放置4h(文献[11]报道为2~4h),然后再置37℃恒温培养的方法,得到了较大的抑菌圈。此外,许多文献[3,4]报道了应用单层培养基可大大降低微生物学方法的检测限,本实验对此也进行了研究,并确定了单碟中培养基的最适加入量。
通过这些改进措施,本法的检测限已由0.8μg/ml(笔者经检验测得)降至0.2μg/ml,并且重复性好、回收率高、操作简便,是一种较好的替代方法,可用于药代动力学实验或进行残留检测。
|
|
|
|
|
|
| |
| |
|

