|
|
| |
| |
 |
N,N’-亚甲基双丙烯酰胺交联淀粉微球的合成及吸附性能 |
赵新法1 李仲谨1,2 王 磊2 肖浩江2 刘节根2 蔡金荣2
(1.陕西科技大学资源与环境学院,咸阳712081;2.陕西科技大学化学与化工学院,咸阳712081)
淀粉微球是天然淀粉的一种人造衍生物,常由淀粉或其改性产物经交联反应合成,常用的交联剂有环氧氯丙烷、POCl3、Na3P3O9、对苯二甲酰氯等[1~3]。淀粉微球的合成及应用研究源于探寻更为合适的靶向制剂载体的工作,已经作为靶向制剂的药物载体在鼻腔给药系统、动脉栓塞技术、放射性治疗、免疫分析等领域得到了应用[4]。淀粉是天然高分子化合物,来源广泛,成本低廉,对环境无毒副作用,可生物降解,是重要的绿色化工原料。与交联淀粉相比,淀粉微球外型规则,粒度均匀,具有空间网状结构,内部孔隙发育,吸附性能更好。在反相悬浮体系中合成N,N′ 亚甲基双丙烯酰胺交联淀粉微球(ASM)属自由基反应机理,交联剂以短链自由基形式参与反应,可以通过改变反应条件调控其聚合程度进而控制ASM的结构与形态,是极具应用前景的合成方法。本研究以可溶性淀粉为原料,K2S2O8 Na2SO3为引发剂,用反相悬浮法合成了N,N′ 亚甲基双丙烯酰胺交联淀粉微球(ASM),探讨了最佳合成工艺条件,考察了ASM对Cu2+、Cr3+、Cd2+、Pb2+的吸附性能。
1 实验部分
1.1 试剂与仪器
可溶性淀粉、环己烷、三氯甲烷、氢氧化钠、乙酸乙酯、丙酮、无水乙醇、Span60、Tween60、K2S2O8、Na2SO3、N,N′ 亚甲基双丙烯酰胺(MBAA)、CuSO4、Cr2(SO4)3、CdCl2、Pb(Ac)2NaCl、MgCl2、ZnCl2等均为分析纯试剂,实验用水为蒸馏水。用光学显微镜观测微球特征;用钨灯丝扫描电子显微镜(JSM 6460,日本电子公司)观察ASM表面形貌;用元素分析仪(ZarioEL3,Elemeraor公司)测定ASM元素组成;用x 射线能谱仪(INCAEnergy,牛津公司)分析ASM表面层元素组成;用光透式粒度分析仪(SKC 2000,日本SEISHIN公司)测定ASM平均粒径和粒度分布;用原子吸收光度计(AA 6800日本岛津有限公司)测定金属离子浓度。1.2 ASM合成组分A:取一定量可溶性淀粉,加入30mL蒸馏水,用氢氧化钠调节pH为8。用水浴加热,80℃搅拌至透明,冷却至50℃,加入适量MBAA,溶解。组分B:量取80mL环己烷和20mL氯仿,置于250mL三口烧瓶中,在回流条件下用水浴加热到50℃,加入1gSpan60 Tween60(mSpan60∶mTween60=9∶1)并使其溶解。合成:保持回流与搅拌,将组分A滴加到组分B中分散至体系呈乳状液。分别加入K2S2O8和Na2SO3,反应2h。移出反应液,离心分离。微球依次用乙酸乙酯、丙酮、无水乙醇洗涤,干燥。产物呈白色至微黄色,产率P(%)按式(1)计算:
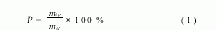
st式中,msp(g)表示ASM质量,mst(g)表示加入可溶性淀粉质量。
1.3 溶胀度测定[2]
称取ASM样品0 5g于100mL烧杯中,加入蒸馏水25mL,放入恒温水浴中,稍加搅拌,在82~85℃溶胀2min(秒表计时),取出冷至室温。倾去上层清液,用滤纸吸去样品表面多余水分后迅速称重,得湿重m1(g)。将样品在105℃下干燥后称重,得干重m2(g)。溶胀度(%)按式(2)计算:
溶胀度=m1/m2×100%(2)
1.4 吸附性能测定
1.4.1 吸附曲线的测定[5]
称取多份ASM各0.2g置于具塞锥形瓶中,分别加入20mL不同浓度的CuSO4、Cr2(SO4)3、CdCl2、Pb(Ac)2溶液,于25℃下恒速(100r/min)振荡6h。取上层清液,用原子吸收光度计测定ce,按式(3)计算吸附容量Qe(mmol·g-1):
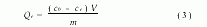
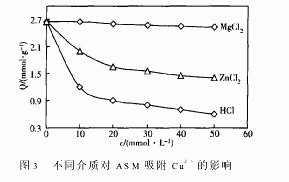
式中,c0,ce(mmol·L-1)分别为原溶液和平衡溶液浓度,V(L)为金属离子溶液体积,m(g)为ASM干重。1.4.2 介质对ASM吸附Cu2+的影响[6]固定CuSO4溶液浓度为50mmol·L-1,电解质HCl、MgCl2、ZnCl2浓度分别为10、20、30、40、50mmol·L-1,振荡温度为25℃,实验方法同1.4.1。
2 结果与讨论
2.1 ASM交联成球机理
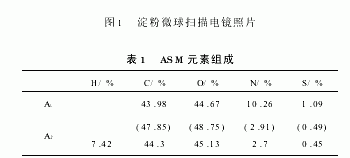
在反相悬浮体系中,可溶性淀粉、MBAA、K2S2O8和Na2SO3溶解于水相,一个小水滴就相当于本体聚合的一个小单元。交联反应始于自由基SO-4·(SO-3·)的生成,在SO4·(SO-3·)的作用下,进一步生成淀粉自由基(以直链淀粉为例),进而发生交联反应。直链淀粉是一种线形多聚物,是由α D 葡萄糖通过α D 1,4糖苷键连接而成的链状分子,呈右手螺旋结构,每个葡萄糖单位组成螺旋的每1个节距。在螺旋内部只含氢原子,是亲油的。羟基位于螺旋外侧,是亲水的。交联反应既可以在同一淀粉分子内部的糖元之间发生,也存在于同一水滴内所溶解的不同淀粉分子之间。MBAA在初级自由基的引发下也可以增长成短链自由基,与交联反应有一定的竞争,部分交联键处于低度均聚状态。反应一经引发就会在淀粉分子结构的全空间进行,但短链自由基的存在可能更有利于在淀粉分子结构的外围发生交联反应。随交联度上升,淀粉分子内(间)链节间作用力增强,结构更紧密,最终形成新的空间网状结构微球体并从水相中析出。在微球形成过程中,淀粉分子因被交联而逐渐收缩并将其中的水分挤出,在微球内留下许多微通道,构成了ASM的内部孔隙。ASM外型规则,粒度均匀,表面光滑致密,见图1。表1是x 射线能谱仪(EDS)分析ASM表面层元素含量(A1)和元素分析仪测定ASM元素组成(A2)的实验数据,括弧内数据是重新归一化处理的结果ASM表面层N、S元素含量明显偏高,支持了交联反应优先淀粉分子结构外围进行的推论。
2.2 ASM合成的影响因素
2.2.1 水油相相体积比(W/O)
可溶性淀粉2g,MBAA0 2g,Span60 Tween60分散剂1g,K2S2O80.04g(nK2S2O8∶nNa2SO3=1∶1)。改变W/O相体积比(V1/V2)合成ASM,在扫描电镜下观察产物形态,结果如表2所示。有机相比例增大有利于成球,产物均匀性好,外型规则。综合考虑传质、传热和成本,V1/V2确定为1∶3。

2.2.2 交联剂用量
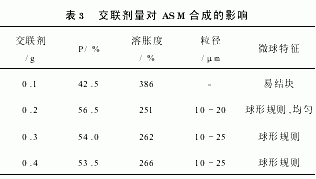
改变交联剂用量,实验结果见表3。交联剂用量小,产率低,淀粉分子交联不充分,溶胀度高。交联剂用量增加,产率增大,交联程度也增加,溶胀度变低。交联剂用量增加到一定数值后,交联程度基本保持不变。一次性加入大量交联剂,MBAA自聚倾向增大,不利于交联成球。氯仿对MBAA有一定的溶解性,交联剂在W/O相之间的分配平衡有助于交联反应持续平稳地进行。
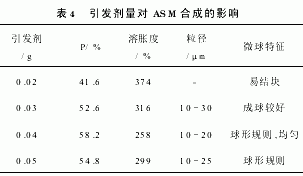
2.2.3 引发剂用量[7]
改变引发剂用量,其影响结果见表4。在较低剂量范围内,随引发剂用量增加,自由基生成速率增加,此时引发剂与淀粉作用生成自由基占主导地位,体系中产生更多的活性中心,交联程度迅速增加。但引发剂用量继续增加,引发交联剂均聚反应的几率也增加,反而导致交联程度降低。
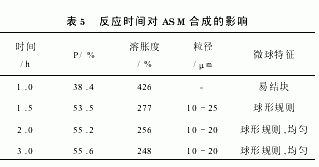
2.2.4 反应时间
反应时间对ASM合成的影响见表5可以看出,在反应初期,随反应时间增加,ASM产率和交联程度急剧增加,在2h后趋于和缓。这是由于反应初期自由基生成速度快,交联反应持续进行,而2h后交联剂已基本消耗殆尽,故产率和交联程度的增加趋于稳定。实验结果确定最佳反应时间为2h。
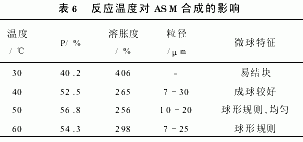
2.2.5 反应温度
反应温度对ASM合成的影响见表6。可以看出,反应温度达到50℃后,产率与交联程度均停止上升而呈下降趋势,这是由淀粉颗粒的性质和自由基反应机理决定的。在30~50℃范围内,随反应温度升高,淀粉颗粒内分子链节间的氢键与分子间作用力被不断削弱,表面分子链可以向水溶液中自由伸展,使交联反应的活性点增多。较高温度也有利于引发剂和交联剂的扩散以及自由基生成速度的加快,但温度过高也会使交联剂均聚速率增大,导致产率与交联程度反而降低。实验结果确定最佳反应温度为50℃。
2.3 ASM的吸附性能
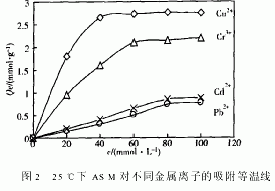
2.3.1 ASM对金属离子的吸附
图2是ASM对不同初始浓度CuSO4、Cr2(SO4)3、CdCl2、Pb(Ac)2的吸附实验结果。随溶液浓度的增大,对4种金属离子的吸附量快速增加。当浓度增大到一定程度后,吸附量增加速度开始减慢,最后出现转折点,吸附量不再增加。最先出现转折点的是Cu2+,接着依次为Cr3+、Cd2+、Pb2+。转折点的吸附量就是该温度下ASM对金属离子的饱和吸附量。在25℃,Cu2+、Cr3+、Cd2+、Pb2+的饱和吸附量分别是2.75、2 20、0.88、0.77mmol·g-1。也即是,以物质的量计,ASM对所实验金属离子的吸附能力次序为Cu2+>Cr3+>Cd2+>Pb2+。
2.3.2 介质对ASM吸附Cu2+的影响
在实际应用中,被吸附的溶液大多是混合物,研究不同介质中ASM对Cu2+的吸附规律具有重要的理论意义和指导实际应用的作用。
ASM的吸附作用主要表现为物理吸附、配位、离子交换、静电引力和微沉淀等形式,它们往往同时存在且相互竞争。ASM结构中含有羟基和乙酰氨基,其空间网状结构使金属离子容易深入内部孔隙并靠近能够产生配位作用的活性点原子如氧、氮等形成多点配位,类似于金属螯合物的形成机理,整个ASM就像一个大的螯合剂分子一样,配位吸附是ASM吸附金属离子的主要作用形式。图3是ASM对Cu2+的吸附量QCu(Ⅱ)在3种典型介质中的变化情况。在HCl介质中,QCu(Ⅱ)随HCl浓度的增加而急剧下降,这可以解释为在酸性条件下,ASM结构中的羟基接受质子H+形成 OH+2[8],弱化甚至消除了羟基的配位螯合能力。在ZnCl2介质中,Zn2+和Cu2+同属过渡金属离子,与ASM之间亦存在配位作用,Zn2+和Cu2+彼此出现了配位竞争。也就是说,Zn2+的存在必然会降低QCu(Ⅱ)且随Zn2+浓度的增大而持续降低。在MgCl2介质中,随Mg2+浓度的增加,QCu(Ⅱ)降低的幅度很小。Mg2+是主族元素,半径小,在同等条件下不产生配位作用,与Cu2+之间没有配位竞争,对QCu(Ⅱ)没有影响,但由于电解质的加入而导致离子强度变化所产生的影响此时可能不容忽略。离子强度的增加必然干扰离子交换吸附,可能导致QCu(Ⅱ)的降低。离子强度的增加也降低了Cu2+的有效浓度,也会使ASM对Cu2+的物理吸附量降低。
3 结 语
本研究是以N,N′ 亚甲基双丙烯酰胺为交联剂,用反相悬浮法合成淀粉微球的新方法。实验表明,最佳合成工艺条件是可溶性淀粉2g,MBAA0.2g,K2S2O80.04g,W/O相体积比1∶3,反应时间2h,反应温度为50℃。ASM对Cu2+、Cr3+、Cd2+、Pb2+饱和吸附量分别为2.75、2.20、0.88、0.77mmol·g-1,配位吸附是ASM吸附金属离子的主要作用形式。资料分析表明,ASM合成工艺条件简单且易于控制,反应时间短,与其他吸附剂相比具有明显的成本优势,是潜在的具有优良性能的工业吸附剂,在含重金属离子废水的处理中有较好的应用前景。
参考文献
[1] HamdiG,PonchelG,DucheneD.Formulationofepichloro hydrincrosslinkedstarchmicrospheres[J].JournalofMicroen capsulation,2001,18(3):373 383.
[2] 于九皋,田汝川,刘延奇.阴离子型淀粉微球的合成及性能研究[J].高等学校化学学报,1994,15(4):616 619.
[3] ShiruiMao,JianmingChen,ZhenpingWei,HuanLiu,Di anzhouBi.Intranasaladministrationofmelatoninstarchmicro spheres[J].InternationalJournalofPharmaceutics,2004,272(1 2):37 43.
[4] 谢彩锋,杨连生,高群玉.纳米淀粉微球的合成及其在生物医药中的应用[J].现代化工,2004,24(9):62 65.
[5] 袁彦超,章明秋,容敏智.交联壳聚糖树脂对Ni(II)的吸附行为研究[J].化学学报,2005,63(18):1753 1758.
[6] 石 光,袁彦超,陈炳稔等.交联壳聚糖的结构及其对不同金属离子的吸附性能[J].应用化学,2005,22(2):195 199.
[7] 尚小琴,童张法,廖丹葵等.反相乳液法淀粉丙烯酰胺接枝共聚反应的研究[J].高校化学工程学报,2006,20(3):460 463.
[8] 赵振国.吸附作用应用原理[M].北京:化学工业出版社,2005. |
|
|
|
|
|
| |
| |
|

